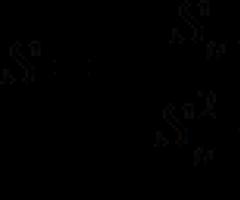Презентация коррозия и ее вред для человека. Коррозия металлов и способы защиты от неё Проект - презентацию выполнили: Ветров Константин Евтеев Кирилл Кириченко Евгений Суслов Владимир






















Описание презентации ПРЕЗЕНТАЦИЯ на тему « « Коррозия металлов по слайдам
Коррозия металлов Введение Химическая коррозия Электрохимическая коррозия Сущность процессов коррозии Способы защиты от коррозии Атмосферная коррозия стали Ингибиторы коррозии металлов
Введение Слово коррозия происходит от латинского «corrodere» , что означает разъедать. Хотя коррозию чаще всего связывают с металлами, но ей подвергаются также камни, пластмассы и другие полимерные материалы и дерево. Например, в настоящее время мы являемся свидетелями большого беспокойства широких слоев людей в связи с тем, что от кислотных дождей катастрофически страдают памятники (здания и скульптуры), выполненные из известняка или мрамора. Таким образом, коррозией называют самопроизвольный процесс разрушения материалов и изделий из них под химическим воздействием окружающей среды. Процессы физического разрушения к коррозии не относят, хотя часто они наносят не меньший вред памятникам культуры. Их называют истиранием, износом, эрозией.
Металлы составляют одну из основ цивилизации на планете Земля. Среди них как конструкционный материал явно выделяется железо. Объем промышленного производства железа примерно в 20 раз больше, чем объем производства всех остальных металлов, вместе взятых. Широкое внедрение железа в промышленное строительство и транспорт произошло на рубеже XVIII. . . XIX вв. В это время появился первый чугунный мост, спущено на воду первое судно, корпус которого был изготовлен из стали, созданы первые железные дороги. Однако начало практического использования человеком железа относят к IX в. до н. э. Именно в этот период человечество из бронзового века перешло в век железный. Тем не менее история свидетельствует о том, что изделия из железа были известны в Хеттском царстве (государство Малой Азии), а его расцвет относят к XIV. . . XIII вв. до н. э.
В природе, хотя и очень редко, но встречается самородное железо. Его происхождение считают метеоритным, т. е. космическим, а не земным. Поэтому первые изделия из железа (они изготавливались из самородков) ценились очень высоко – гораздо выше, чем из серебра и даже золота.
Несмотря на широкое внедрение в нашу сегодняшнюю жизнь полимерных материалов, стекла, керамики, основным конструкционным материалом продолжает оставаться железо и сплавы на его основе. С изделиями из железа мы на каждом шагу встречаемся в быту и знаем, как много хлопот доставляют его ржавление и сама ржавчина. Ржавлением называют только коррозию железа и его сплавов. Другие металлы коррозируют, но не ржавеют. Хотя коррозируют практически все металлы, в повседневной жизни человек чаще всего сталкивается с коррозией железа.
Химическая коррозия Химическую коррозию стали вызывают сухие газы и жидкости, не имеющие характера электролитов, например органические соединения или растворы неорганических веществ в органических растворителях, Химическая коррозия не сопровождается возникновением электрического тока. Она основана на реакции между металлом и агрессивным реагентом. Этот вид коррозии протекает в основном равномерно по всей поверхности металла. В связи с этим химическая коррозия менее опасна, чем электрохимическая.
Продукты коррозии могут образовывать на поверхности металла плотный защитный слой, затормаживающий её дальнейшее развитие, или же пористый слой, не защищающий поверхность от разрушающего воздействия среды. В этом случае процесс коррозии продолжается до полного разрушения материала или период времени пока будет действовать агрессивная среда. Наиболее часто на практике встречается газовая коррозия стали, вызванная воздействием О 2 , SO 2 , H 2 S, CI, НС 1, NO 3 , CO 2 , CO и H 2.
Электрохимическая коррозия Электрохимическая коррозия происходит при взаимодействии металлов с жидкими электролитами, в основном растворами кислот, оснований и солей. Механизм процесса коррозии зависит от структуры металла, а так же от типа электролита. Сталь, как всякий металл, имеет кристаллическое строение, при котором атомы располагаются в соответствующем порядке, образуя характерную пространственную решетку. Кристаллы железа имеют строение, значительно отличающиеся от идеальной схемы, так как имеются пустоты, не занятые атомами металла, трещины, включения примесей к газов.
Металлы обладают хорошей электропроводностью, что обусловлено наличием свободных электронов, движение которых создает электрический ток. Числу свободных электронов соответствует эквивалентное число ион- атомов, т. е. атомов, утративших один или более электрон. В случае возникновения на концах металлического стержня разности потенциалов электроны движутся от полюса с высшим потенциалом к противоположному полюсу. Металлы, обладающие электронной проводимостью, являются проводниками первого рода, а электролиты которые имеют ионную проводимость проводниками второго рода.
В зависимости от типа и содержания растворённых в воде солей изменению подвергаются не только нормальные потенциалы, но даже положение металла в ряду потенциалов.
Сущность процессов коррозии. Коррозия металлов чаще всего сводится к их окислению и превращению в оксиды. В частности, коррозия железа может быть описана упрощенным уравнением 4 Fe + 3 O 2 + 2 H 2 О = 2 Fe 2 O 3·H 2 О Гидратированный оксид железа Fе 2 O 3·H 2 О и является тем, что люди называют ржавчиной. Это рыхлый порошок светло-коричневого цвета. Многие металлы при коррозии покрываются плотной, хорошо скрепленной с металлами оксидной пленкой, которая не позволяет кислороду воздуха и воде проникнуть в более глубокие слои и потому предохраняет металл от дальнейшего окисления. Например, алюминий – очень активный металл и теоретически с водой должен был бы взаимодействовать в соответствии с уравнением 2 Al + 3 H 2 О = Al 2 O 3 + 3 H
Строго отделить химическую коррозию от электрохимической трудно, а иногда и невозможно. Дело в том, что электрохимическая коррозия часто связана с наличием в металле случайных примесей или специально введенных легирующих добавок.
Способы защиты от коррозии. Проблема защиты металлов от коррозии возникла почти в самом начале их использования. Люди пытались защитить металлы от атмосферного воздействия с помощью жира, масел, а позднее и покрытием другими металлами и прежде всего легкоплавким оловом (лужением). В трудах древнегреческого историка Геродота (V в. до н. э.) уже имеется упоминание о применении олова для защиты железа от коррозии.
Для защиты чугунных и стальных водяных труб от коррозии используют цементные покрытия. Поскольку коэффициенты теплового расширения портландцемента и стали близки, а стоимость цемента невысокая, то он довольно широко применяется для этих целей. Недостаток портландцементных покрытий тот же, что и эмалевых, – высокая чувствительность к механическим ударам.
Широко распространенным способом защиты металлов от коррозии является покрытие их слоем других металлов. Покрывающие металлы сами коррозируют с малой скоростью, так как покрываются плотной оксидной пленкой. Покрывающий слой наносят различными методами: кратковременным погружением в ванну с расплавленным металлом (горячее покрытие), электроосаждением из водных растворов электролитов (гальваническое покрытие), напылением (металлизация), обработкой порошками при повышенной температуре в специальном барабане (диффузионное покрытие), с помощью газофазной реакции, например 3 Cr. Cl 2 + 2 Fe – → 2 Fe. Cl 3 + 3 Cr (в сплаве с Fe).
Имеются и другие методы нанесения металлических покрытий, например, разновидностью диффузионного способа защиты металлов является погружение изделий в расплав хлорида кальция Ca. Cl 2, в котором растворены наносимые металлы.
Атмосферная коррозия стали Наиболее часто встречающимся на практике типом коррозии стали является образование ржавчины под влиянием атмосферных воздействий (чаще всего кислорода и влажности), В сухом атмосферном воздухе сталь практически не подвергается коррозии. Атмосферная коррозия носит электрохимический характер, причем электролитом является слой влаги, имеющийся на поверхности металла.
Протекание процессов коррозии в атмосферных условиях аналогично коррозии стали в воде, содержащей кислород. Продукты коррозии, покрывающие металл, представляют собой гидра тированные окиси железа с составом, определяемым формулой Скорость атмосферной коррозии зависит от содержания влаги в воздухе. Повышение относительной влажности воздуха до 70 -75% приводит к сравнительно небольшим потерям стали. При влажности, превышающей эти значения, наблюдается интенсивное ускорение процессов коррозии. Загрязнение воздуха агрессивными продуктами такими, как СО 2, SО 2, CI 2, H 2 S, дым и сажа, усиливает коррозию. Сталь, в течение нескольких летлет подвергавшаяся воздействию промышленной атмосферы, имеет значительно большие потери, чем сталь в условиях сельской местности.
Ингибиторы Применение ингибиторов – один из эффективных способов борьбы с коррозией металлов в различных агрессивных средах (в атмосферных, в морской воде, в охлаждающих жидкостях и солевых растворах, в окислительных условиях и т. д.). Ингибиторы – это вещества, способные в малых количествах замедлять протекание химических процессов или останавливать их. Название ингибитор происходит от лат. inhibere, что означает сдерживать, останавливать. Ингибиторы взаимодействуют с промежуточными продуктами реакции или с активными центрами, на которых протекают химические превращения. Они весьма специфичны для каждой группы химических реакций. Коррозия металлов – это лишь один из типов химических реакций, которые поддаются действию ингибиторов. По современным представлениям защитное действие ингибиторов связано с их адсорбцией на поверхности металлов и торможением анодных и катодных процессов.
Первые ингибиторы были найдены случайно, опытным путем, и часто становились клановым секретом. Известно, что дамасские мастера для снятия окалины и ржавчины пользовались растворами серной кислоты с добавками пивных дрожжей, муки, крахмала. Эти примеси были одними из первых ингибиторов. Они не позволяли кислоте действовать на оружейный металл, в результате чего растворялись лишь окалина и ржавчина.
По данным 1980 г. , число известных науке ингибиторов коррозии превысило 5 тыс. Считают, что 1 т ингибитора дает в народном хозяйстве экономию около 5000 руб. Работа по борьбе с коррозией имеет важнейшее народнохозяйственное значение. Это весьма благодатная область для приложения сил и способностей.
Слайд 2
Слайд 3
Слайд 4
Слайд 5
Слайд 6
Цель
Исследовать действие факторов окружающей среды на степень ржавления металлов. Гипотеза Если поместить железо в щелочную среду, то скорость коррозии уменьшится.
Слайд 7
Задачи
1. Изучить сущность коррозии, её виды и способы защиты от коррозии. 2.Исследовать зависимость скорости коррозии от присутствия кислорода. 3.Исследовать влияние электролитов на процесс коррозии. 4.Исследовать влияние ингибиторов на процесс коррозии.
Слайд 8
Значение коррозии
1. Вызывает серьезные экологические последствия: утечка нефти, газа, других химических продуктов. 2.Недопустима во многих отраслях промышленности: авиационной, химического, нефтяного и атомного машиностроения. 3.Отрицательно влияет на жизнь и здоровье людей.
Слайд 9
Коррозия - гетерогенный процесс который происходит на границе раздела фаз «металл - окружающая среда». В результате коррозии металлы окисляются и переходят в устойчивые соединения - оксиды или соли, в виде которых они и находятся в природе.
Слайд 10
В случае химическойкоррозии происходит взаимодействие металла непосредственно с окислителем окружающей среды. В результате этого разрушается металлическая связь, и атомы металла соединяются с атомами и группами атомов, входящих в состав окислителей. 2Fe0+3Cl20→-2Fe+3Cl3 3Fe+2O2→Fe3O4 Химическая коррозия.
Слайд 11
Электрохимическая коррозия
Этот вид коррозии встречается наиболее часто и представляет собой процесс взаимодействия металлов и сплавов с электролитами, сопровождающийся самопроизвольным возникновением гальванических пар «катод - анод». Анод на железе(+) Катод на меди(-)Fe 0-2e=Fe2+2H++2e=2H0 →H20
Слайд 12
Факторы вызывающие коррозию
1. Кислород и влага атмосферы 2. Углекислый и сернистый газы, содержащие в атмосфере 3. Морская вода 4. Грунтовые воды
Слайд 13
Эксперимент №1. Роль кислорода в процессе коррозии железа. В пробирке №1-ж. гвоздь+вода на половину. В пробирке №2-ж. гвоздь+вода полностью. В пробирке №3-ж. гвозды-вода+масло.
Слайд 14
Слайд 15
Слайд 16
Эксперимент№2. Влияние электролитов на процесс коррозии. В стакане №1-ж. гвоздь + вода. В стакане №2-ж. гвоздь + раствор хлорида натрия. В стакане №3-ж. гвоздь + медь + раствор хлорида натрия. В стакане №4-ж. гвоздь + алюминий + раствор хлорида натрия.
Слайд 17
Слайд 18
Слайд 19
Эксперимент №3. Влияние ингибиторов на процесс коррозии. В пробирке №1 - ж. гвоздь + раствор гидроксида натрия. В пробирке №2 - ж. гвоздь + раствор фосфата натрия. В пробирке №3 - ж. гвоздь + раствор дихромата натрия.
Слайд 20
Слайд 21
По результатам исследований были сделаны следующие выводы:
1.Коррозия железа резко усиливается в присутствии кислорода. 2.Коррозия железа резко усиливается, если он соприкасается с менее активным металлом, но коррозия замедляется, если железо соприкасается с более активным металлом. 3. Скорость коррозии зависит от состава омывающей металл среды. Хлорид ионы усиливают коррозию железа. 4. Коррозия железа ослабляется в присутствии гидроксид - ионов, фосфат - ионов и хромат - ионов.


- Мы должны выяснить, что такое коррозия металлов?
- Какие виды коррозии бывают?
- Как протекает этот процесс?
- Какова роль коррозии в жизни человеческого общества и зачем ее изучать?
- Какие способы защиты от нее существуют?

- Понятие коррозии
- Виды коррозии
- Химизм процесса коррозии
- Значение коррозии
- Способы защиты от коррозии

Коррозия
происходит от латинского «corrosio» ,
что означает разъедать, разрушать.

- Ржавчина, которая появляется на поверхности стальных и чугунных изделий, - это яркий пример коррозии.
- Ржавлением называют только коррозию железа и его сплавов. Другие металлы коррозируют, но не ржавеют.
- Коррозией металлов называют самопроизвольный процесс разрушения металлов и изделий из них под воздействием окружающей среды.

Классификация коррозии
По характеру разрушения:
1. сплошная коррозия, распределяется равномерно по всей поверхности металла или сплава (например, процесс ржавления сплавов железа на воздухе или их взаимодействие с сильными кислотами).
2. локальная (местная) коррозия, охватывающая отдельные участки:
- пятнами;
- язвенная;
- точечная
- сквозная;

- химическую коррозию;
- электрохимическую коррозию.

Химическая коррозия металлов
это разрушение металлов в результате их прямого химического взаимодействия с веществами окружающей среды.

Наиболее распространенным видом химической коррозии является газовая коррозия, проистекающая в сухих газах при полном отсутствии влаги. Газообразное вещество окружающей среды реагирует с металлом на поверхности металлического изделия и образует с ним соединения.
2Fe+3SO 2 +3O 2 → Fe 2 (SO 4 ) 3
2Fe+3Cl 2 →2 FeCL 3

Опыт№ 1. Влияние различных электролитов на скорость коррозии металлов (в зависимости от рН).
- пробирка №1 -3 мл NaCl, рН=7
- пробирка №2 – 3 мл NaCl +2 каплиNaOH, рН=12
- пробирка №3- дист. вода + 2 капли H 2 SO 4 , рН=2
- пробирка №4- вода дист., рН=7
- пробирка №5- водопроводная вода, рН определить по универсальной индикаторной бумаге.
Во все пробирки добавьте по 2 капли раствора красной кровяной соли, K 3 и опустите в каждую железный гвоздь.


Состав раствора
Очередность окрашивания
H2O водопровод.

Электрохимическая коррозия - это разрушение металлов, которое сопровождается возникновением
электрического тока.

При электрохимической коррозии
(наиболее частая форма коррозии)
всегда требуется наличие электролита (конденсат, дождевая вода и т. д.),
с которым соприкасаются электроды -
либо различные элементы структуры материала, либо два различных соприкасающихся материала с различающимися окислительно-восстановительными потенциалами.

Образуется коррозионный элемент.
Он представляет собой не что иное, как замкнутую гальваническую ячейку. В ней происходит медленное растворение более активного металла,
второй электрод в паре, как правило, не корродирует.

Опыт№ 2. Химическая и электрохимическая коррозия цинка.
Влияние образование гальванопар на скорость коррозии цинка.
- В две пробирки налейте по 3 мл 2 н раствора соляной кислоты и внесите по одной грануле цинка. Наблюдайте выделение газов в пробирках. Составьте химическое и электронное уравнения протекающей реакции.
- В одну из пробирок введите медную проволоку, не касаясь кусочка цинка.
Взаимодействует ли медь с кислотой?
- Опустите медную проволоку до соприкосновения с гранулой цинка
Что происходит? Наблюдайте выделение водорода с поверхности меди и на скорость реакции по сравнению с первой пробиркой. Что в данном случае является анодом и катодом?
Составьте электронные уравнения электродных процессов.

Рассмотрим электрохимическую коррозию железного образца, имеющего вкрапления олова. Железо более активный металл. При контакте с электролитом часть атомов железа, окисляясь переходит в раствор:
Fe 0 -2е= Fe 2+ (анод) разрушается.
В кислой среде. На олове (катод)восстанавливаются ионы водорода:
2Н + + 2е- = Н 2
Fe 0 +2Н + → Fe 2+ +Н 2
В щелочной и нейтральной среде. На олове (катод) восстанавливается кислород, растворенный в воде
О 2 +2Н 2 О+4е→4ОН - ;
ионы железа Fe 2+ реагируют с гидоксид-анионами
Fe 2+ +2ОН - → Fe(ОН) 2 .
4Fe(ОН) 2 + O 2 + 2H 2 О = 4 Fe(OH) 3
4Fe+ 3O 2 + 6H 2 О = 4 Fe(OH) 3
Fe(OH) 3 и является ржавчиной.








1 из 38
Презентация - Коррозия металлов и способы защиты от коррозии
Текст этой презентации
Урок химии по теме “Коррозия металлов и способы защиты от коррозии"
Подготовила учитель химии СШ РГКП «Республиканский центр реабилитации для детей и подростков»
Лепесбаева Сандугаш Кайратовна

Цели урока:
сформировать представление учащихся о механизме коррозийных процессов, об их последствиях и способах защиты от коррозии; развивать умение работать с опорным конспектом, наблюдать, делать выводы; воспитывать эмоциональное отношение к изучаемому явлению.

Чугун
Сплав железа с углеродом (2-4%)
Сталь
Сплав железа с углеродом (меньше 2%)
Применяется в фасонном литье
При добавлении легирующих элементов улучшает качества

В III до нашей эры на острове Родос был построен маяк в виде огромной статуи Гелиоса. Колосс Родосский считался одним из семи чудес света, однако просуществовал всего 66 лет и рухнул во время землетрясения. У Колосса Родосского бронзовая оболочка была смонтирована На железном каркасе. Под действием влажного, насыщенного солями средиземноморского воздуха
железный каркас разрушился.

Что является символом Парижа? – Эйфелева башня. Она неизлечима больна, ржавеет и разрушается, и только постоянная химиотерапия помогает бороться с этим смертельным недугом: её красили 18 раз, отчего её масса 9000 т каждый раз увеличивается на 70 т.

Коррозия – рыжая крыса,
Грызёт металлический лом.
В. Шефнер
Ежегодно в мире «теряется» до ¼ произведённого железа…

А.Н.Несмеянов
Знать – значит победить!

Путешествие по царству «Рыжего дъявола»
ст. Информационная
ст. Экспериментальная
ст. Практическая

разрушение металлов и сплавов под воздействием окружающей среды.
Коррозия

Виды коррозии
По характеру разрушения сплошная (общая):
равномерная, неравномерная локальная(местная):
точечная, пятнами, язвами, подповерхностная, сквозная и др.

Виды коррозии
сплошная точечная
Язвенная межкристаллитная

Химическая коррозия
- металл разрушается в результате его химического взаимодействия с агрессивной средой (сухими газами, жидкостями-неэлектролитами).
Образование окалины при взаимодействии материалов на основе железа при высокой температуре с кислородом: 8ē
3Fe0 + 2O20 → (Fe+2Fe2+3)O4-2
Видео- фрагмент
Лабораторный опыт – накаливание медной проволоки

Электрохимическая коррозия
- в среде электролита возникает электрический ток при контакте двух металлов (или на поверхности одного металла, имеющего неоднородную структуру);
- коррозия напоминает работу гальванического элемента: происходит перенос электронов от одного участка металла к другому (от металла к включению).
Видео- фрагмент

Образующиеся на аноде ионы Fe2+ окисляются до Fe3+ : 4Fe2+ (водн.) + O2 (г.) + (2n + 4)H2O (ж.) = 2Fe2O3 nH2O (тв.) + 8H+ (водн.)
Коррозия металла на влажном воздухе


Железо слабо прокорродировало в воде, в чистой воде коррозия идет медленнее, т. к. вода слабый электролит.
Сравним результаты опытов № 2 и № 5

Добавка к воде NaCl усиливает коррозию Fe. добавка к раствору NaCl – NaOH, как видно из опыта, наоборот ослабила коррозию, ржавчины получилось мало.
Сравним результаты опытов № 1 и № 2

Т. о. скорость коррозии данного металла зависит от состава омывающей среды. Одни составные части омывающий металл среды, в частности Cl- - ионы усиливают коррозию металлов, другие составные части могут ослаблять коррозию. Коррозия Fe ослабевает в присутствии OH- - ионов.

В обоих случаях Fe находится в одном и том же растворе, но в одном случае оно соприкасается с цинком, а в другом нет.
В пробирке № 2 осадок бурого цвета – это ржавчина, а в пробирке № 4 осадок – белого цвета – это Zn(OH)2
Вывод: В опыте № 4 корродировало не Fe, а Zn , т. к. железо почти не корродирует, если оно соприкасается с цинком.
Сравним результаты опытов № 2 и № 4

Окисляется Zn, как более активный металл
А (-)
отщепляющиеся от его атомов
перемещаются на поверхность Fe и восстанавливают
К (+) Fe

В обоих случаях Fe находится в одном и том же растворе, но в одном случае оно соприкасается с медью, а в другом нет. В обеих пробирках произошла коррозия и появился бурый осадок ржавчины.
В пробирке №2 ржавчины получилось меньше, чем в пробирке №3.
Вывод: таким образом, коррозия и ржавление железа сильно усиливается, когда оно соприкасается с медью.
Сравним результаты опытов № 2 и № 3

А (-)
К (+) Cu
Реакция растворенного в воде кислорода с железом приводит к образованию бурой ржавчины.

Коррозия металла резко усиливается, если он соприкасается с каким-либо другим, менее активным металлом, т. е. расположенным в электрохимическом ряду напряжений металлов правее его. Но коррозия замедляется, если металл соприкасается с другим металлом, расположенным левее в электрохимическом ряду напряжений металлов, т. е. более активным.


Защита от коррозии
- Изоляция металла от среды - - Изменение среды

Барьерная защита
- механическая изоляция поверхности при использовании поверхностных защитных покрытий:
неметаллических (лаки, краски, смазки, эмали, гуммирование (резина), полимеры); металлических (Zn, Sn, Al, Cr, Ni, Ag, Au и др.); химических (пассивирование концентрированной азотной кислотой, оксодирование, науглероживание и др.)

Барьерная защита

Какое поверхностное защитное покрытие использовалось в данном случае? К какой группе поверхностных
защитных покрытий оно относится?
Видео- фрагмент
Барьерная защита

Изменение состава металла (сплава)
Протекторная защита
- добавление в материал покрытия порошковых металлов, создающих с металлом донорские электронные пары; создание контакта с более активным металлом (для стали - цинк, магний, алюминий).
Под действием агрессивной среды постепенно растворяется порошок добавки, а основной материал коррозии не подвергается.

К основной конструкции прикрепляются заклёпки или пластины из более активного металла, которые и подвергаются разрушению. Такую защиту используют в подводных и подземных сооружениях.

Пропускание электрического тока в направлении, противоположном тому, который возникает в процессе коррозии.
Изменение состава металла (сплава)
Электрозащита

В повседневной жизни человек чаще всего встречается с покрытиями железа цинком и оловом. Листовое железо, покрытое цинком, называют оцинкованным железом, а покрытое оловом – белой жестью. Первое в больших количествах идет на кровли домов, а из второго изготавливают консервные банки.
Изменение состава металла (сплава)
Видео- фрагмент

Введение в металл легирующих добавок: Cr, Ni, Ti, Mn, Mo, V, W и др.
Изменение состава металла (сплава)
Легирование

Изменение среды
Ингибирование
Введение веществ, замедляющих коррозию (ингибиторов): - для кислотной коррозии: азотсодержащие органические основания, альдегиды, белки, серосодержащие органические вещества; - в нейтральной среде: растворимые фосфаты (Na3PO4), дихроматы (K2Cr2O7), сода (Na2CO3), силикаты (Na2SiO3);
- при атмосферной коррозии: амины, нитраты и карбонаты аминов, сложные эфиры карбоновых кислот.

В какой пробирке гвоздь не заржавел и почему?
Изменение среды

Изменение среды
Деаэрация - удаление веществ, вызывающих коррозию: нагревание воды;
пропускание воды через железные стружки; химическое удаление кислорода (например, 2Na2SO3 + O2 → 2Na2SO4).

Подумай и объясни (домашнее задание)
1. В раствор хлороводородной (соляной) кислоты поместили пластинку из Zn и пластинку из Zn, частично покрытую Cu. В каком случае процесс коррозии происходит интенсивнее? Ответ мотивируйте, составив электронные уравнения соответствующих процессов.
2. Как протекает атмосферная коррозия железа, покрытого слоем никеля, если покрытие нарушено? Составьте электронные уравнения анодного и катодного процессов.

1. На уроке я работал 2. Своей работой на уроке я 3.Урок для меня показался 4. Мое настроение 6. Материал урока мне был активно / пассивно доволен / не доволен коротким / длинным стало лучше / стало хуже понятен / не понятен
полезен / бесполезен
интересен / скучен
Рефлексия
Код для вставки видеоплеера презентации на свой сайт:
Назад
Вперёд
Внимание! Предварительный просмотр слайдов используется исключительно в ознакомительных целях и может не давать представления о всех возможностях презентации. Если вас заинтересовала данная работа, пожалуйста, загрузите полную версию.
На уроке используются фронтальные и индивидуальные формы работы с учащимися. Основными педагогическими технологиями данного проекта урока являются технологии проблемного и разноуровневого обучения, ИКТ, технологии здоровьесбережения.
Цель урока: познакомить учащихся с процессом разрушения металлов – коррозией и определить способы защиты от неё.
Задачи урока:
- повторить вопрос о нахождении металлов в природе, устройство и работу гальванического элемента;
- дать представление о коррозии и её механизме;
- познакомить с разными видами коррозии по характеру разрушения;
- дать понятие о способах защиты металлов от коррозии.
План урока
Этап урока |
Краткое содержание |
I. Организационный этап. |
Приветствие учителя и учащихся |
II. Актуализация знаний. Подготовка к изучению нового материала. |
Повторение ранее изученного материала (беседа): а) нахождение металлов в природе, б) металлы – восстановители. Формулирование выводов. |
III. Изучение нового материала. |
Сообщение темы, цели урока, плана работы на уроке. Изучение материала по плану: 1) Введение понятия «коррозия» (рассказ с элементами беседы). 2) Характер разрушения и виды коррозии в зависимости от него (сообщение учащихся). 3) Механизмы протекания химической и электрохимической коррозии металлов (рассказ с использованием схем, самостоятельная работа учащихся по составлению в тетради схемы-конспекта) а. механизм и условия химической коррозии б. механизм и условия электрохимической коррозии (объяснение по схеме, выполнение заданий учащимися, демонстрация результатов эксперимента). 4) Основные способы защиты металлов от коррозии (сообщение учащихся, демонстрация результатов эксперимента). |
IV. Основные выводы по уроку, закрепление изученного материала. |
Формулирование выводов. Выполнение заданий на первичное усвоение материала: ученики со средним уровнем подготовленности выполняют тест; сильные учащиеся работают по индивидуальным заданиям на объяснение механизма коррозии. Оценивание учащихся. Дифференцированное домашнее задание. |
Ход урока
I этап урока - Организационный.
- Приветствие учителя и учащихся.
I I этап урока – Актуализация знаний учащихся. Подготовка к изучению нового материала.
- Учитель проводит фронтальную беседу с учащимися по следующим вопросам (примерные ответы учащихся приведены курсивом) :
Какие металлы встречаются в природе и в каком состоянии? (благородные металлы встречаются в свободном состоянии, остальные - в виде различных соединений).
Т.е. существует две формы металлов: Ме 0 - восстановленная, Ме n+ - окисленная.
Какой процесс наблюдается при получении металлов из их соединений? (процесс восстановления металлов, что можно отразить в виде схемы: Ме n+ + n ē = Ме 0 ).
На проведение процесса восстановления металлов из их соединений затрачивается энергия.
Какое состояние наиболее выгодно и более устойчиво для металлов? (в виде соединений, в виде положительно заряженных ионов).
- Учитель сообщает тему урока, цели и задачи.
III этап урока – Изучение нового материала.
- Учитель сообщает ученикам план работы на уроке и дает задание: составить схему – конспект по ходу объяснения нового материала. По ходу урока будут выступления отдельных ребят по подготовленным заранее заданиям. В конце урока вас ожидает самостоятельная работа по новому материалу.
- Учитель вводит понятие «коррозия», рассказывает о потерях, вызываемых эти процессом и пр. Использует слайды презентации (слайды 1, 2, 3 презентации).
(Примерный рассказ учителя).
При попадании металла в естественные (природные) условия происходит обратный процесс – окисление металлов, металлы возвращаются в устойчивое для них состояние в виде ионов. Процесс окисления (ржавления) наиболее часто приходится наблюдать для железа и его сплавов (чугуна и стали). Ежегодно во всём мире производится более 500 млн. т стали, но едва ли не ¼ ее «погибает». Ржавеют и выходят из строя механизмы, машины. Сколько труда тратится на их замену!
Результатом коррозии являются потери: прямые (потери массы металла) и косвенные (утрата важнейших свойств). Так, в ноябре 2007 года в журнале «Огонек» была помещена заметка о происшествии в Керченском заливе. В ней сообщалось о том, что во время сильного шторма затонуло 12 судов. Все они были насквозь проржавевшими. Один из них - танкер «Волгонефть-139» даже разломился пополам. В результате этого происшествия в море вылилось 2000 т мазута, и несколько десятков километров береговой линии оказались загрязненными. Погибли тысячи птиц, а самое страшное, что погибли люди. Предварительный ущерб составил 30 млрд. рублей. Этот случай не является единичным.
Следует подчеркнуть, что коррозия – это самопроизвольный процесс разрушения металлов в окружающей среде под действием ее условий. С точки зрения химии коррозия – это окислительно-восстановительный процесс, при котором происходит окисление металла: Ме 0 - n ē = Ме n+ . Внешне это проявляется, как вы уже поняли и знаете, в виде ржавчины, оксидных плёнок и др.
Но разрушению подвергаются металлы по-разному.
- Учащиеся делают сообщение о классификации видов коррозии по различным признакам (подготовлено в качестве предварительного домашнего задания), используют слайды презентации (слайды 4, 5 презентации), приводят примеры:
- по механизму (т.е. как протекает, в каких условиях)
- химическая – разрушение металлов при непосредственном контакте со средой (например, нагревание пластинки из меди и ее почернение на воздухе – газовая коррозия; коррозия в присутствии нефти, бензина и т.д., т.е. в среде неэлектролита);
- электрохимическая – разрушение металлов в растворах, где есть катодные и анодные процессы.
До 80% коррозия протекает в атмосфере, остальное - в почве, жидкостях; под напряжением.
- по видам разрушений выделяют общую или сплошную коррозию (равномерную и неравномерную) и местную (точечную, пятнами, язвами, межкристаллитную).
- Учитель дает пояснения о механизмах коррозии и объясняет их по схемам на слайдах (слайды 6, 7, 8, 9 презентации):
При химической коррозии идет окисление металла без возникновения цепи электрического тока. Это обычный процесс окисления металлов в среде неэлектролита (например, разрушение стали в газовой среде при высоких температурах /доменная печь/). Механизм напоминает работу гальванического элемента. Демонстрация видеофрагмента и объяснение по схеме (образование ржавчины (Рисунок 1)) (слайды 7, 8 презентации).

Рисунок 1
Электрохимическая коррозия происходит в результате действия множества микро- и макрогальванических элементов, возникающих приконтакте металлов, в присутствии примесей, в сплавах. Объяснения по схеме (коррозия железа при контакте с медью) (слайд 9 презентации).
- Фронтальная работа учащихся класса с заданиями. Ответы учащихся на вопросы заданий (окисление железа при контакте его с оловом (Рисунок 2), окисление цинка (Рисунок 3)) (слайды 10, 11 презентации).

Рисунок 2

Рисунок 3
- Учитель демонстрирует результаты предварительно поставленных опытов (приложение 1) и проводит фронтальную беседу с классом.
Коррозия будет возрастать, если поверхность металла имеет щели, зазубринки, пыль, примеси и др., при различных атмосферных условиях. Рассмотрите коррозию железа в … (приложение 1 к уроку). Где процесс протекает быстрее и чем вы это объясните?
Победить коррозию до конца никогда не удастся, так как металлы стремятся вернуться в свое «естественное состояние» (в виде ионов). Речь может идти только о снижении темпов коррозии. Из сказанного следует, что очень важной проблемой является нахождение эффективных способов защиты от коррозии.
Каким образом можно предотвратить коррозию металлов? Или хотя бы уменьшить её действие на металлы?
- Учащиеся делают сообщение о способах защиты металлов от коррозии, сопровождая показом слайдов презентации (слайды 11, 12, 13, 14, 15, 16, 17 презентации). Учитель иллюстрирует сообщение результатами предварительно подготовленного демонстрационного эксперимента.
IV этап урока - Основные выводы по уроку, закрепление изученного материала.
- Учащиеся под руководством учителя формулируют выводы по уроку.
Итак, сегодня мы познакомились с новым для вас процессом разрушения металлов. Что это за процесс?
Что вы можете сказать о верности высказывания «прочен как сталь»? Всегда ли верно оно?
Какие виды коррозии существуют?
Как можно предотвратить коррозию или уменьшить её действие?
- Учитель предлагает учащимся со средним уровнем подготовленности выполнить тест на бланках (приложение 2) (при наличии оборудования тест может быть проведен в системе АИС «Знак»), сильным ученикам – письменно ответить на вопросы (приложение 2 к уроку, слайд 18 презентации).
- Выставление оценок за урок.
- Домашнее задание (можно предложить учащимся на выбор). Комментарии к его выполнению (приложение 3 , слайд 19 презентации).